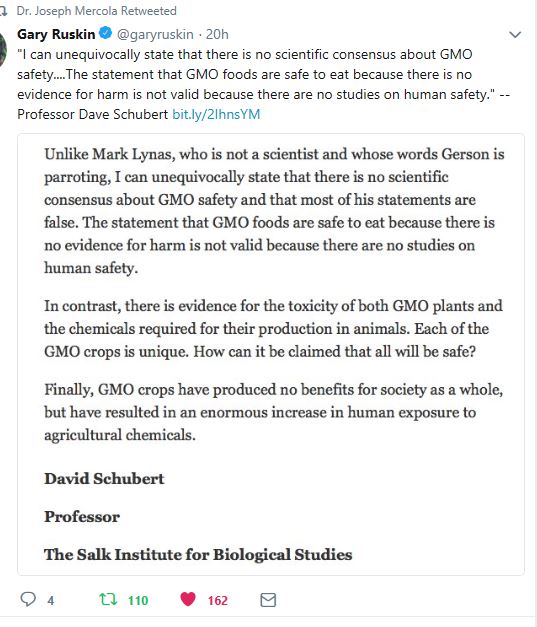
The San Diego Union-Tribune. 13-05-2018.Your Opinions | The science is still out on GMO food safety. Bron
Bezwaarschriften en de daarbij horende correspondentie met overheden (RVS, VROM M&I etc.

The San Diego Union-Tribune. 13-05-2018.Your Opinions | The science is still out on GMO food safety. Bron
We schreven een commentaar op:
EFSA scientific opinion on an application for the placing on the market of food, feed and other products containing or consisting of genetically modified maize MON 87403 and food and feed produced from this maize.
Lees verder “Commentaar op nieuwe toelating gentech mais door de EU”
Zie hier voor meer info. De handtekeningenlijst zelf.
Aanvraag:
Op 5 juli 2017 heeft het Ministerie van Infrastructuur en Waterstaat (hierna: IenW) van het Academisch Ziekenhuis behorende bij de openbare universiteit Rotterdam te Rotterdam een vergunningaanvraag op grond van het Besluit genetisch gemodificeerde organismen milieubeheer 2013 (hierna: Besluit ggo) ontvangen voor introductie in het milieu van genetisch gemodificeerde organismen. De aanvraag is geregistreerd met het kenmerk GGO IM-MV 17-005. De aanvraag heeft betrekking op klinische studies waarin autologe T-cellen van patiënten met B-cel maligniteiten ex vivo getransduceerd (genetische modificatie) worden met een lentivirale vector welke een transmembrane, chimere anti-CD19 receptor tot expressie brengt. De getransduceerde T-cellen worden weer teruggegeven aan de patiënten met als doel het induceren van een afweerreactie tegen de B-cel maligniteiten. De werkzaamheden zijn voorgenomen plaats te vinden in de gemeente Rotterdam. Advertentie. Notifier: Celgene Corporation, USA.
Deze medische gentech proef toont overeenkomsten met die van kenmerk IM-MV 17-006. De zienswijze van De Gentechvrije Burgers hierover is in uw bezit. U gelieve die als ingelast te beschouwen.
Uit de aanvraag, schokkend weer embryonale cellen gebruikt:
The 293T cell line is a highly transfectable derivative of human embryonic kidney 293 cells,….
Ons commentaar: Het gaat hier weer om een zeer zwaar traject, waarbij patiënten last kunnen krijgen van ernstige bijwerkingen: Neurotoxicity.
Another class of adverse events that has been observed with anti-CD19 CAR T cell therapy is central nervous system toxicity including hallucinations, delirium, aphasia, confusion and somnolence. These toxicities range from mild to severe and in extreme cases may require ventilatory support for airway protection.
Bovendien:
“De te gebruiken virale vector is afgeleid van Human Immunodeficiency Virus 1 (HIV-1) (A2.2, A2.8)”
“Niemand mag schade worden berokkend, zelfs niet als daar voor anderen iets goeds uit zou komen.” – Edmund D. Pellegrino, hoogleraar Medicijnen en Medische Ethiek.
13 juni 2018.
Zienswijze (mogelijkheid om een handtekening te zetten, u kunt deze niet meer opsturen).
Aanvulling zienswijze op 15 mei 2018:
Advies COGEM was niet bekend, publicatie op 12 juni 2018. Dat is één dag voor de definitieve datum dat mensen een zienswijze kunnen indienen. Het advies van de COGEM wordt dus niet afgewacht maar er wordt gewoon al toestemming gegeven door het ministerie. Dat is vreemd.
COGEM: VERWACHT 12.06.2018
Het uiteindelijke COGEM advies
“Advies klinische studie naar de veiligheid en werkzaamheid van genetisch gemodificeerde T-cellen in patiënten met agressieve B-cel maligniteiten
De COGEM is gevraagd te adviseren over een klinische studie naar de behandeling van B-cel maligniteiten met behulp van genetisch gemodificeerde (gg-)T-cellen. De gg-T-cellen zijn vervaardigd met een vector afgeleid van het Human immunodeficiency virus 1 (HIV-1) en brengen een chimere antigeen receptor (CAR) tot expressie.”
Advertentie van het ministerie van I&W
Het uiteindelijke COGEM advies
De EMA (European Medicines Agency, binnenkort in Nederland gevestigd) beslist hierover.
EMA: Public summary of opinion on orphan designation.
Opinions on orphan medicinal product designations are based on the following three criteria:
Designated orphan medicinal products are products that are still under investigation and are considered for orphan designation on the basis of potential activity. An orphan designation is not a marketing authorisation. As a consequence, demonstration of quality, safety and efficacy is necessary before a product can be granted a marketing authorisation.
Klik hier om naar de desbetreffende pagina te gaan en hier om naar invulpagina te gaan.
Vertel de EPA (USA) dat je geen verlenging wilt van glyfosaat en andere bestrijdingsmiddelen (waar onder ook pesticiden), wij stuurden een Pdf mee getiteld: Spinning Science & Silencing Scientists.
A Case Study in How the Chemical Industry Attempts to Influence Science
Door ons ingevulde pagina.
https://www.dotcomnieuws.com/gmo/bezwaar-tegen-gentech-therapieproef-op-kankerpatientjes-en-jongvolwassenen/
Menselijke embryocellijnen worden tegenwoordig gebruikt bij de vervaardiging van vaccins maar zitten ook in een gentech preparaat dat nu als proef getest gaat worden op jonge kankerpatiëntjes en jong volwassenen in Utrecht in het nieuwe kinderkankerziekenhuis (opening in mei 2018) aldaar. Het is een onzekere proef met veel ernstige bijwerkingen, dit bleek uit een eerdere proef. Klik hier voor meer informatie. Wil je er tegen ageren mail ons dan via info@gentechvrij.nl Wij zullen een zienswijze sturen.
 Lees verder “Nieuwe zienswijze tegen gentech proef tegen kanker met jonge patientjes en jong volwassenen met kanker”
Lees verder “Nieuwe zienswijze tegen gentech proef tegen kanker met jonge patientjes en jong volwassenen met kanker”
11 december 2017.
Zienswijze, bezwaar en open brief tegen GGO IM-MV 17-004 .
5 januari 2018.
Aanvulling 1, 2 en 3 (5, 8 en 12 januari 2018) op de zienswijze, bezwaar en open brief en extra informatie (17 januari) nadat we op 17 januari 2018 een antwoord kregen van Dr. Andriukaitis, European Commissioner for Health and Food Safety: aan de staatssecretaris van I en W Mevr. S. van Veldhoven (in handen) tegen GGO IM-MV 17-004 en meer achtergrondinformatie.
25 januari 2018
Samenvatting van de hierboven vermelde stukken gericht aan de staatssecretaris.
27 januari 2018
28 januari 2018
Short Press Release in English: Newborns from South Africa as guinea pigs.

Vergunningaanvraag oktober 2017 (Er zijn meerdere aanvraagformulieren opgestuurd).
SNIF nr. 2 (Summary Notification Information Format), juni 2017.
Op 16 juni 2017 heeft het toenmalige Ministerie van Infrastructuur en Milieu van Stichting Het Nederlands Kanker Instituut – Antoni van Leeuwenhoek Ziekenhuis te Amsterdam een vergunningaanvraag op grond van het Besluit genetisch gemodificeerde organismen milieubeheer 2013 (hierna: Besluit ggo) ontvangen voor introductie in het milieu van genetisch gemodificeerde organismen. De aanvraag is geregistreerd met het kenmerk GGO IM-MV 17-004.
De aanvraag betreft een klinische studiewaarin genetisch gemodificeerde Mycobacterium bovis BCG stam bacteriën via de blaas worden toegediend aan patiënten met blaaskanker. De bacteriën brengen het listeriolysine eiwit afkomstig van Listeria monocytogenes tot expressie. Het doel hiervan is het opwekken van een afweerreactie tegen de blaastumor. De werkzaamheden zijn voorgenomen plaats te vinden in de gemeente Amsterdam.

“Niemand mag schade worden berokkend, zelfs niet als daar voor anderen iets goeds uit zou komen.” – Edmund D. Pellegrino, hoogleraar Medicijnen en Medische Ethiek.
Rijksoverheid: Meer mogelijkheden wetenschappelijk onderzoek met kinderen . Fragment:
“Toekomstige patiënten
De wijziging betekent een verruiming van de mogelijkheden om onderzoek te doen met kinderen en meerderjarige wilsonbekwamen. Het gaat om
onderzoek dat niet direct ten goede komt aan de proefpersoon zelf, maar wel in het belang is van toekomstige patiënten.
Voorwaarde is dan dat de belasting hooguit minimaal meer mag zijn dan de op dat moment gangbare standaard behandeling. Bijvoorbeeld een extra buisje bloed afnemen, een scan maken of een biopt nemen.”
Ons commentaar: Het gaat hier om een zeer zwaar traject, waarbij patiënten last kunnen krijgen van ernstige bijwerkingen zoals is gebleken tijdens een eerdere proef in de VS.
Zienswijze (8 februari 2018) en aanvulling 1 (25 februari 2018) en 2 (5 maart 2018) daarop vanwege IM MV 17-006.
Advertentie van het ministerie van I&W
Advies COGEM uit 2016, dus oud!
Reacties van het ministerie op onze zienswijze via de Beschikking (fragment).
Jonge mensen willen gewoon gelukkig zijn. © Miep Bos.
Vergunningsaanvraag
Op 29 november 2017 heeft het Ministerie van Infrastructuur en Waterstaat (hierna: IenW) van het Prinses Máxima Centrum voor Kinderoncologie B.V. te Utrecht een vergunningaanvraag op grond van het Besluit genetisch gemodificeerde organismen milieubeheer 2013 (hierna: Besluit ggo) ontvangen voor introductie in het milieu van genetisch gemodificeerde organismen. De aanvraag is geregistreerd met het kenmerk GGO IM-MV 17-006.
De aanvraag heeft betrekking op klinische studies waarin autologe T-cellen van patiënten met B-cel maligniteiten ex vivo getransduceerd (genetische modificatie) worden met een lentivirale vector welke een transmembrane, chimere anti-CD19 receptor (CAR-19) tot expressie brengt. De getransduceerde T-cellen worden weer teruggegeven aan de patiënten met als doel het induceren van een afweerreactie tegen de B-cel maligniteiten. De werkzaamheden zijn voorgenomen plaats te vinden in de gemeente Utrecht.
Waarover gaat deze proef en de complete informatie klik hier.
3 en 23 maart 2018
Maize NK603 x MON810
Opinion of the Scientific Panel on Genetically Modified Organisms on an assessment of genetically modified maize NK603 x MON810 for renewal of authorisation under Regulation (EC) No 1829/2003 (application EFSA-GMO-RX-007)

Aanvraag:
Op 5 juli 2017 heeft het Ministerie van Infrastructuur en Waterstaat (hierna: IenW) van het Academisch Ziekenhuis behorende bij de openbare universiteit Rotterdam te Rotterdam een vergunningaanvraag op grond van het Besluit genetisch gemodificeerde organismen milieubeheer 2013 (hierna: Besluit ggo) ontvangen voor introductie in het milieu van genetisch gemodificeerde organismen. De aanvraag is geregistreerd met het kenmerk GGO IM-MV 17-005. De aanvraag heeft betrekking op klinische studies waarin autologe T-cellen van patiënten met B-cel maligniteiten ex vivo getransduceerd (genetische modificatie) worden met een lentivirale vector welke een transmembrane, chimere anti-CD19 receptor tot expressie brengt. De getransduceerde T-cellen worden weer teruggegeven aan de patiënten met als doel het induceren van een afweerreactie tegen de B-cel maligniteiten. De werkzaamheden zijn voorgenomen plaats te vinden in de gemeente Rotterdam. Advertentie. Notifier: Celgene Corporation, USA.
8 mei 2018
Onze korte zienswijze:
Deze medische gentech proef toont overeenkomsten met die van kenmerk IM-MV 17-006. De zienswijze van De Gentechvrije Burgers hierover is in uw bezit. U gelieve die als ingelast te beschouwen. Meer….
13 juni 2018.
Zienswijze (met mogelijkheid om een handtekening te zetten, u kunt deze niet meer opsturen.
Advertentie van het ministerie van I&W
Aanvulling zienswijze op 15 mei 2018:
Advies COGEM niet bekend, waarschijnlijk publicatie in juni 2018. Dat is één dag voor de definitieve datum dat mensen een zienswijze kunnen indienen. Het advies van de COGEM wordt dus niet afgewacht maar er wordt gewoon al toestemming gegeven door het ministerie. Dat is vreemd.
Het uiteindelijke COGEM advies
“Advies klinische studie naar de veiligheid en werkzaamheid van genetisch gemodificeerde T-cellen in patiënten met agressieve B-cel maligniteiten
De COGEM is gevraagd te adviseren over een klinische studie naar de behandeling van B-cel maligniteiten met behulp van genetisch gemodificeerde (gg-)T-cellen. De gg-T-cellen zijn vervaardigd met een vector afgeleid van het Human immunodeficiency virus 1 (HIV-1) en brengen een chimere antigeen receptor (CAR) tot expressie.”
DATUM 15 mei 2018, KENMERK CGM/180515-01, ONDERWERP Advies hernieuwing vergunning import en verwerking gg-sojalijn A2704-1
Waarom staan MIR604 en 5307 er niet bij?
17 mei 2018
We schreven een commentaar op:
EFSA scientific opinion on an application for the placing on the market of food, feed and other products containing or consisting of genetically modified maize MON 87403 and food and feed produced from this maize.
20 mei 2018
We schreven een eerste commentaar en een tweede commentaar op:
Cotton GHB614 x LLCotton25 x MON15985
Quote: Point of collection: commercial variety of USA and other countries Characteristics related to biosafety: not different from other cotton varieties except for tolerance to herbicides glyphosate and glufosinate ammonium and to resistance to certain pests of the Lepidoptera family.
Overall opinion on application for authorisation of genetically modified cotton GHB614 x LLCotton25 x MON 15985 for food and feed uses submitted under Regulation (EC) No 1829/2003 by Bayer (EFSA-GMO-NL-2011-94).
APPROVED: 12 April 2018 PUBLISHED: 19 April 2018
www.efsa.europa.eu/publications EFSA Supporting publication 2018:EN-1409
Overall opinion of the European Food Safety Authority on genetically modified cotton GHB614 × LLCotton25 × MON 15985 for food and feed uses, under Regulation (EC) No 1829/2003
(application EFSA-GMO-NL-2011-94)
European Food Safety Authority
23 mei

26 mei 2018
Ons commentaar in twee delen. Ook commentaar in opdracht van Stichting Ekopark.
Maize 4114
EFSA Scientific Opinion on the assessment of genetically modified maize 4114 for food and feed uses, under Regulation (EC) No 1829/2003 (application EFSA-GMO-NL-2014-123)
2 juli 2018
11 juli
25 juli
Cotton GHB614 x T304-40 x GHB119
Overall opinion on application for authorisation of genetically modified cotton GHB614 x T304-40 x GHB119 for food and feed uses submitted under Regulation (EC) No 1829/2003 by Bayer (EFSA- GMO-NL-2014-122)
25 juli 2018

By Claus Bunks aka Afrobrasil on flickr [Public domain], from Wikimedia Commons
Commentaar van een Nederlander:
Sorry,
Maar ik zie de gentech anjer “Moonaqua” niet zitten.
Geen enkele gentech bloem overigens. Je weet waar het begint, maar je weet niet waar het eindigt.
Het is ermee zoals met exotische planten en vissen die hier geen natuurlijke vijanden hebben en alles gaan overwoekeren. Je weet niet wat de toekomst brengt mbt de natuur, als de gentech mensen al lang overleden zijn.
Met vriendelijke groeten,
Overall opinion on application for authorisation of genetically modified Soybean MON 87751 for food and feed uses submitted under Regulation (EC) No 1829/2003 by Monsanto (EFSA- GMO-NL-2014-121)
GM Bt toxin is immunogenic, allergenic, and causes pre-cancerous intestinal changes.
29 oktober 2018
Vergunningaanvraag
Op 20 juni 2018 heeft het Ministerie van Infrastructuur en Waterstaat (hierna: IenW) van het Universitair Medisch Centrum Utrecht te Utrecht een vergunningaanvraag op grond van het Besluit genetisch gemodificeerde organismen milieubeheer 2013 (hierna: Besluit ggo) ontvangen voor introductie in het milieu van genetisch gemodificeerde organismen. De aanvraag is geregistreerd met het kenmerk GGO IM-MV 18-009.
De aanvraag betreft klinische studies waarin autologe T-cellen van patiënten met maligniteiten, die B cell maturation antigen (BCMA) tot expressie brengen, ex vivo getransduceerd (genetische modificatie) worden met een lentivirale vector. Deze vector brengt een transmembrane, chimere anti-BCMA receptor (anti-BCMA CAR) tot expressie. De getransduceerde T-cellen worden weer teruggegeven aan de patiënten met als doel het induceren van een afweerreactie tegen deze maligniteiten.
De werkzaamheden zijn voorgenomen plaats te vinden in de gemeente Utrecht. Advertentie
Het is in ieder geval duidelijk dat er nu ook weer tevens zeer zieke kinderen behandeld zullen worden, wat niet in de advertentie staat. Verder is er een grote overeenkomst met eerdere proeven. Deze proef vertoond overeenkomsten met de kenmerken GGO IM-MV 16-003, GGO IM-MV 16-004, GGO IM-MV 16-005, GGO IM-MV 16-006 en GGO IM-MV 16-007.
RESULTATEN IM-MV 16-007:
3.1. Beschrijf de resultaten van de verrichte werkzaamheden:
“Er is 1 patiënt geïncludeerd in de studie in oktober 2017. De behandeling is met succes uitgevoerd. Een maand na toediening van het product was er nog minimale ziekte-activiteit. De patiënt ervaarde de verwachte bijwerkingen welke toegeschreven werd aan de immuun activatie. Dit kon volledig onder controle gebracht worden met ondersteuning. Er hebben zich geen complicaties voorgedaan ten gevolge van het studie product. Helaas is de patiënt in december 2017 overleden aan infectieuze complicaties van de ziekte en eerdere behandelingen.”
3.4. Beschrijf de onverwachte neveneffecten geconstateerd bij het uitvoeren van specifieke testen:
“Patient reageerde goed op de behandeling. Hij is helaas overleden ten gevolge van een virale luchtweginfectie. Deze infectie is waarschijnlijk ten gevolge van zijn verminderde imuunstatus welke het gevolg is van de eerdere chemotherapeutische behandelingen en niet ten gevolge van een onverwacht neveneffect van het toegediende GGO.”
Milieurisicoanalyse MER (Eng.)
Zienswijze wordt aan gewerkt.
Beschikking
Soybean MON 89788EFSA Scientific Opinion on the Assessment of genetically modified soybean MON 89788 for renewal of authorisation under Regulation (EC) No 1829/2003
|
LLCotton25EFSA Scientific Opinion on the Assessment of genetically modified LLCotton25 for renewal of authorisation under Regulation (EC) No 1829/2003
|
Maize MZHG0JGOverall opinion on application for authorisation of genetically modified maize MZHG0JG for food and feed uses submitted under Regulation (EC) No 1829/2003 by Syngenta (EFSA- GMO-DE-2016-133)
|
Vergunningaanvragen
Op 16 mei 2018, 4juli2018 en 14 september 2018 heeft het Ministerie van Infrastructuur en Waterstaat (hierna: lenW) van respectievelijk het Universitair Medisch Centrum Groningen te Groningen, het Prinses Máxima Centrum voor Kinderoncologie 8. V. te Utrecht en het Academisch Ziekenhuis behorende bij de openbare universiteit Rotterdam te Rotterdam vergunningaanvragen op grond van het Besluit genetisch gemodificeerde organismen milieubeheer 2073 (hierna: Besluit ggo) ontvangen voor introductie in het milieu van genetisch gemodificeerde organismen.
De aanvragen zijn geregistreerd met de kenmerken GGO IM-MV 18-003, GGO IM-MV 1 8-010 en GGO IM-MV 7 8-075.
De aanvraag van het Universitair Medisch Centrum Groningen betreft een klinische studie in patiënten met glycogen storage disease type la (GSD1a). GSD1a is een ernstige, erfelijke metabole ziekte.
Patiënten worden behandeld met een replicatie deficiënt genetisch gemodificeerd adenovirus geassocieerd virus (rAA V), waarin een sequentie is ingebracht die codeert voor het humane G6Pase eiwit. De virale vector (DTX4OI) is ontworpen om de G6Pase sequentie in levercellen van patiënten met GSDIa te introduceren, waar het expressie van het G6Pase enzym zal bewerkstelligen. Het doel van de klinische studie is om de veiligheid en werkzaamheid van een eenmalige intraveneuze toediening van DTX4OI te evalueren voor de behandeling van patiënten met GSDIa.
De aanvraag van het Prinses Máxima Centrum voor Kinderoncologie 8. V. betreft klinische studies waarin autologe T-cellen van patiënten met 8-cel tumoren ex vivo getransduceerd (genetische modificatie) worden met een lentivirale vector welke een transmembrane, chimere anti-CD19 receptor tot expressie brengt. De getransduceerde T-cellen worden weer teruggegeven aan de patiënten met
als doel het induceren van een afweerreactie tegen de 8-cel tumoren.
De aanvraag van het Academisch Ziekenhuis behorende bij de openbare universiteit Rotterdam betreft een klinische studie in patiënten met Hemofilie A (bloederziekte). Hemofilie A is een ernstige, erfelijke bloedziekte veroorzaakt door een tekort aan functioneel factor VIII (FVlll). Patiënten worden behandeld met een replicatie deficiënt genetisch gemodificeerd adenovirus-geassocieerd virus (rAA V),
waarin een sequentie is ingebracht die codeert voor de humane factor VIII sequentie waarvan het 8-domein verwijderd is (hFVllI-BDD). De virale vector (BAY 2599023/DTX2O7) is ontworpen om de FVIII-BDD sequentie in levercellen van patiënten met hemofilie A te introduceren, waar het expressie van hFVIII-BDD zal bewerkstelligen.
Beschikking, voor alle aanvragen gelijk voor wat betreft het antwoord op onze zienswijzen. Lees hoe het ministerie telkens weer hetzelfde antwoord geeft, respectloos en dat al jaren. Daarom vinden we het tijd om onze energie ergens anders in te gaan stoppen!
Zie een voorbeeld hier uit:
4. De indiener van de zienswijzen geeft aan dat zij het zwijgen van talrijke deskundigen die weten dat het experimenten zijn, waarvan we de uitkomst zelfs niet kunnen vermoeden, nog het ergste vindt. Waarom is Nederland toch zo voor gentech proeven? Andere landen zijn terecht kritisch! Deze clinical trials mogen niet doorgaan.
Reactie: De mogelijke schadelijke effecten voor mens en milieu zijn uitgebreid beschouwd in de milieurisicobeoordeling, waaruit blijkt dat de toepassing van het ggo niet zal leiden tot een risico voor mens en milieu. De COGEM heeft positief geadviseerd (CGM/181231-02) over de milieurisicobeoordeling en geconcludeerd dat de risico’s voor mens en milieu verwaarloosbaar klein zijn. De mogelijke risico’s, eventuele voordelen voor de patiënten en andere medisch ethische aspecten verbonden aan klinische studies worden beoordeeld door de Centrale Commissie Mensgebonden Onderzoek (CCMO). De CCMO waarborgt de bescherming van proefpersonen betrokken bij medisch-wetenschappelijk onderzoek. Het onderzoeksvoorstel wordt door de CCMO getoetst volgens de criteria van de Wet medisch-wetenschappelijk onderzoek met mensen (WMO).
Overige gevens zie de database van het ministerie.
Onze zienwijzen inclusief IM-MV 18-004.
27 december 2006.
Bezwaren en bedenkingen tegen voornemen gentechproefvelden te weten;
| Procedure | IM |
| Dossiernummer | IM 06-005, IM 06-006, IM 06-007. |
| Taakveld | Landbouw |
| Rechtspersoon | Pioneer Hi-Bred Northern Europe Sales Division |
| Titel | Application for the deliberate release of genetically modified 59122x1507xNK603 maize |
27 december 2006
Bedenking IM 06-005
Bedenking IM 06-006
Bedenking IM 06-007
27 december 2006
5 januari 2007
Persbericht en brief aan de Kamercommissie van LNV
16 juli 2008
Robert A. Verlinden: prejudiciële vragen aan de Raad van State, inzake DGM/SAS IM 06-006 (ggo-maïs, RvS nummer 200702758/1/M1. Onderwerp: Haaksbergen, Venray en Werkendam Veldproeven met genetisch gemodificeerde maïs .
Greenpeace en Robert Verlinden kregen gelijk van de Raad van State, hier is de uitspraak van 9 september 2009.

Bezwaar tegen gentech mini anjers.
Hoe ging het stemmen in de EU door Appeal Committee:
6. Exchange of views and possible opinion of the Committee on a draft Commission
Implementing Decision concerning the placing on the market, in accordance with
Directive 2001/18/EC of the European Parliament and of the Council, of a
carnation (Dianthus caryophyllus L., line 25958) genetically modified for flower
colour
SANTE/10174/2015
Draft Decision concerning the placing on the market, in accordance with Directive 2001/18/EC, of a carnation (Dianthus caryophyllus L., line 25958) genetically modified for flower colour, was presented to the Committee.
Vote taken: no opinion
Reasons for the negative vote or abstention:
− No agreed national position
− Negative public opinion
− Political reasons
− Risk assessment deemed not sufficient
− Human-aided propagation cannot be excluded
− Potential spread of pollen and cross-pollination cannot be excluded
− Social utility of this GMO is unclear
In the light of Article 4(6) of the Rules of procedure of the Appeal Committee, the Chair
informed the members of the Committee that the file would be submitted to the Commission for adoption.
7. Exchange of views and possible opinion of the Committee on a draft Commission
Implementing Decision concerning the placing on the market, in accordance with
Directive 2001/18/EC of the European Parliament and of the Council, of a
carnation (Dianthus caryophyllus L., line 26407) genetically modified for flower
colour
SANTE/10175/2015
Draft Decision concerning the placing on the market, in accordance with Directive 2001/18/EC,
of a carnation (Dianthus caryophyllus L., line 26407) genetically modified for flower colour,
was presented to the Committee.
Vote taken: no opinion
Reasons for the negative vote or abstention:
− No agreed national position
− Negative public opinion
− Political reasons
− Risk assessment deemed not sufficient
− Human-aided propagation cannot be excluded
− Potential spread of pollen and cross-pollination cannot be excluded
− Social utility of this GMO is unclear
In the light of Article 4(6) of the Rules of procedure of the Appeal Committee, the Chair
informed the members of the Committee that the file would be submitted to the Commission for adoption.

24-11-2015. PLEITNOTA voorgelezen door Maria Lieve van Stichting Ekopark, Lelystad. Zij heeft de gehele pleitnota voor-
gelezen. Aanwezig waren verder: Mevr. L. Mast, Natuurwetmoeders, de heer W. Braakman, biologische bollenkweker,
Mevr. Wieteke van Dort, actrice en kunstenares, Mevr. M. Bos, kunstenares en woordvoerster van de Gentechvrije Burgers (ook namens MADGE incorporated Australia)
en de heer Toine Heijmans, Volkskrantjournalist. Lees hier zijn stuk over de hoorzitting. Van de kant van het ministerie waren aanwezig;
Mevr. M. Drossaers, de heer J. Geurts en Mevr. I. de Kort. Foto: Lindeke Mast.
Verslagje:
Er werd begonnen met het inschenken van koffie en thee. Daarna volgde een voorstelronde. Toen de heer Heijmans aan de beurt was, vertelde hij dat hij een Volkskrantjournalist is, waarop ambtenaar Mr. G. ongerust zei: “U gaat hier toch zeker geen stukje over schrijven?” Waarop de heer Heijmans zei dat dat wel de bedoeling was. Toen wendde men zich tot Miep Bos. “Dat heeft u ons niet medegedeeld!” “Welzeker wel, antwoordde ze, ik heb geschreven dat er iemand kwam met journalistieke belangstelling” . Waarop de journalist mocht blijven. De ambtenaren vonden de pleitnota te lang duren, of het korter kon. Mevrouw Lieve deed een poging maar zei daarna dat het sneller zou gaan als ze gewoon alles voor zou lezen dan een keuze uit de tekst te maken. Alles werd op een band opgenomen of we bezwaar hadden. Iedereen kon ook nog zijn of haar zegje doen. Natuurlijk ging het weer over belanghebbendheid van de stichtingen. Ja en als die niet regelmatig lezingen hadden gehouden, waren die niet ontvankelijk. Waar hebben we dat meer gehoord? Bij de Raad van State, die nu even gekopieerd werd. Dit was allemaal belangrijker dan de vervuiling in het milieu die een gentech organisme kan veroorzaken. Waar liggen de prioriteiten in Nederland bij de overheid? We denken dat u dat wel kan raden!
5 oktober 2015: Antwoord Gentechvrije Burgers aan ministerie van IenM.

Handtekeningenlijst Nederlands verlopen.
Signature list English Print it out, sign it and sent it to the ministry (address is on the list). Or scan it and send your scanned lists to info(a)gentechvrij.nl An email of the Ministry tells me that the Postbox number 20906 no longer exists and must be Postbus 20901, please forward widely.! Real deadline is 25th of August 2015.
Names of the carnations: FLORIGENE ® MoonberryT and FLORIGENE ® MoonvelvetT . (photos).
The Dutch minister of Environment will give her consent to the placing on the EU market of 2 GM spray carnations of Florigene named Moonvelvet and Moonberry. GGO C/NL/09/01 and GGO C/NL/09/02. The European GMO-free Citizens wrote a petition which you can sign. The signature list need not to be full of signatures. One is also enough. You can print the list ( only REAL signatures are accepted by the ministry).
EU country Cyprus is right not to want those GM spray carnations on the EU market and in the environment! But still they are approved by the EU!
Sign and send your scanned signature list before the 20th of August. Please forward this news! Info over the GM carnations can be found via the database of the ministry: ( GGO C/NL/09/01 and GGO C/NL/09/02). For the latest GMO news you can follow me via Twitter @MiepBos
Kennisgeving Besluit genetisch gemodificeerde organismen milieubeheer
Introductie in het milieu voor het in de handel brengen van genetisch gemodificeerde organismen.
Beschikking op de vergunningaanvragen van Florigene Ltd.
Op 9 juli 2015 zijn door het Ministerie van Infrastructuur en Milieu (hierna: IenM), vergunningen verleend, met kenmerk GGO C/NL/09/01 en GGO C/NL/09/02 , voor het in de handel brengen van genetisch gemodificeerde organismen krachtens artikel 23 van het Besluit genetisch gemodificeerde organismen milieubeheer, geldend ten tijde van de ontvangst van de aanvraag (hierna: Besluit ggo) aan Florigene Ltd., gevestigd in Melbourne, in Australië.
De beschikkingen zijn op 20 juli 2015 aan Florigene Ltd. verzonden . Op 12 maart 2009 had Florigene Ltd. daartoe strekkende aanvragen ingediend. De genetisch gemodificeerde organismen die als product in de handel worden gebracht ten behoeve van import zijn snijbloemen van anjer ( Dianthus caryophyllus L.) met een gewijzigde bloemkleur, gemodificeerd met Agrobacterium tumefaciens stam AGL0, met behulp van de vector pCGP3366 respectievelijk pCGP2355, wat lijn 25958 (C/NL/09/01) en lijn 26407 (C/NL/09/02) heeft opgeleverd.
Procedure
Voor de behandeling van de aanvragen van Florigene Ltd. is de procedure doorlopen als beschreven in paragraaf 3.3 van het Besluit ggo en deel C van de Richtlijn 2001/18/EG van het Europees Parlement en de Raad van de Europese Unie van 12 maart 2001 inzake de doelbewuste introductie van genetisch gemodificeerde organismen in het milieu. Op 30 april 2015 zijn de positieve beschikkingen van de Europese Commissie met nr. 2015/692/EG en 2015/694/EG gepubliceerd in het publicatieblad van de Europese Unie (PB L 112). Deze beschikkingen zijn gericht aan de Minister van IenM om vergunning te verlenen aan Florigene Ltd. om Dianthus caryophyllus , lijn 25958 en 26407, in de handel te brengen.
Inzage beschikking
De beschikkingen en de overige relevante stukken liggen vanaf 21 juli 2015 op werkdagen ter inzage bij het Rijksinstituut voor Volksgezondheid en Milieu, RIVM/VSP/Bureau GGO, Antonie van Leeuwenhoeklaan 9, Postbus 1, 3720 BA Bilthoven. De stukken kunnen daar ingezien worden van maandag t/m vrijdag van 10:00 tot 16.00 uur na afspraak via telefoon of mail (tel. (030) 2742793, e-mail bggo@rivm.nl). De bezoeker dient zich met een geldig identiteitsbewijs te melden bij de receptie.
Deze kennisgeving, de beschikkingen en de bijbehorende stukken zijn ook beschikbaar op de internetpagina http://www.ggo-vergunningverlening.nl/ .
Bezwaar
Op grond van de Algemene wet bestuursrecht kunnen belanghebbenden een bezwaarschrift indienen tegen deze besluiten binnen zes weken na de dag waarop deze bekend zijn gemaakt. Het bezwaarschrift moet worden gericht aan
de Staatssecretaris van Infrastructuur en Milieu, ter attentie van Hoofddirectie Bestuurlijke en Juridische Zaken, afdeling Algemeen Bestuurlijk-Juridische Zaken, postbus 20906, 2500 EX Den Haag.
Het bezwaarschrift dient te zijn ondertekend en tenminste te bevatten:
a. naam en adres van de indiener;
b. de dagtekening;
c. een omschrijving van het besluit waartegen het bezwaarschrift zich richt (datum en nummer of kenmerk);
d. een opgave van de redenen waarom men zich met het besluit niet kan verenigen;
e. zo mogelijk een afschrift van het besluit waartegen het bezwaarschrift zich richt. Het niet voldoen aan deze eisen kan leiden tot niet-ontvankelijkheid van het bezwaarschrift.
23-07-15 Reactie op “Genetisch gemanipuleerde trosanjer eindelijk in de EU verkocht” uit de Volkskrant werd niet geplaatst.
Geachte Redactie,
Hoogleraar Mol denkt dat hij wel een gentech trosanjer kan gaan kopen, noteert Maarten Keulemans. (Volkskrant van 22 juli 2015). Maar dat kan voorlopig nog niet. “Belanghebbenden” (en wie zijn dat niet?) hebben nog 5,5 week de tijd om een bezwaarschrift te sturen vanwege de Beschikkingen van het ministerie van Infrastructuur en Milieu waarin staat, dat deze gentech trosanjers het groene licht krijgen. En als Nederland, waar de aanvraag sinds 2009 loopt, dan toch toestemming geeft, zou de hoogleraar er goed aan doen, de uitgebloeide gentechanjers na gebruik in de Chemobox te deponeren. Ze zijn nl. geproduceerd met behulp van het bloemkoolmozaïekvirus.
Dr. Joseph Cummins, Professor Emeritus in de genetica aan de universiteit van West-Ontario waarschuwt o.a. voor het veelvuldig gebruikte bloemkoolmozaïekvirus, dit is in ieder geval een potentieel gevaarlijk gen. Het is een pararetrovirus hetgeen betekent dat het zich vermenigvuldigt door DNA te maken van RNA-boodschappen. Het lijkt heel veel op het hepatitis-B-virus en is verwant aan HIV.
Vriendelijke groet,
Miep Bos
Mae-Wan Ho1, Angela Ryan1 and Joe Cummins2 : CaMV 35S Promoter Fragmentation Hotspot Confirmed, and it is Active in Animals.